Selfcare : dispositifs médicaux et compléments alimentaires, un duo gagnant
Le selfcare, autrement dit la démarche d’automédication, a transformé les habitudes de santé : le patient-consommateur s’informe, compare, arbitre. En officine, dispositifs médicaux et compléments alimentaires se côtoient, parfois pour des indications communes (maux de gorge, digestion, peau, minceur), mais ne reposent ni sur le même mécanisme d’action ni sur la même finalité d’usage. Pourtant, ce duo de produits peut devenir une stratégie gagnante : des réponses complémentaires pour le consommateur, et une architecture de gamme performante pour les marques du selfcare.
Depuis la pandémie de COVID en 2019, prendre soin de sa santé et de son bien-être de façon proactive (et préventive) est une démarche qui s’est ancrée dans les habitudes du quotidien, une forme d’automédication responsable désormais intégrée dans les comportements de santé.
Le succès du marché des produits selfcare en quelques chiffres
Selon NèreS (ex-AFIPA), le marché du selfcare regroupe les produits de premier recours, c’est-à-dire les médicaments à prescription facultative, les compléments alimentaires et les dispositifs médicaux disponibles en officine.
Entre 2019 et 2024, le secteur a connu une croissance globale de +22 %, portée par une hausse du nombre de visites en pharmacie (périmètre France) : 340 millions en 2024, contre 297 millions en 2020. La pandémie de COVID-19 a joué un rôle de catalyseur, amenant de nombreux Français à se tourner vers leur pharmacien comme premier interlocuteur santé dans une logique d’automédication encadrée.1
Les compléments alimentaires enregistrent la progression la plus marquée avec +56,4 %, suivis des dispositifs médicaux grand public en hausse de +27,3 %, tandis que les médicaments sans ordonnance affichent une croissance plus modérée de +4,6 %.
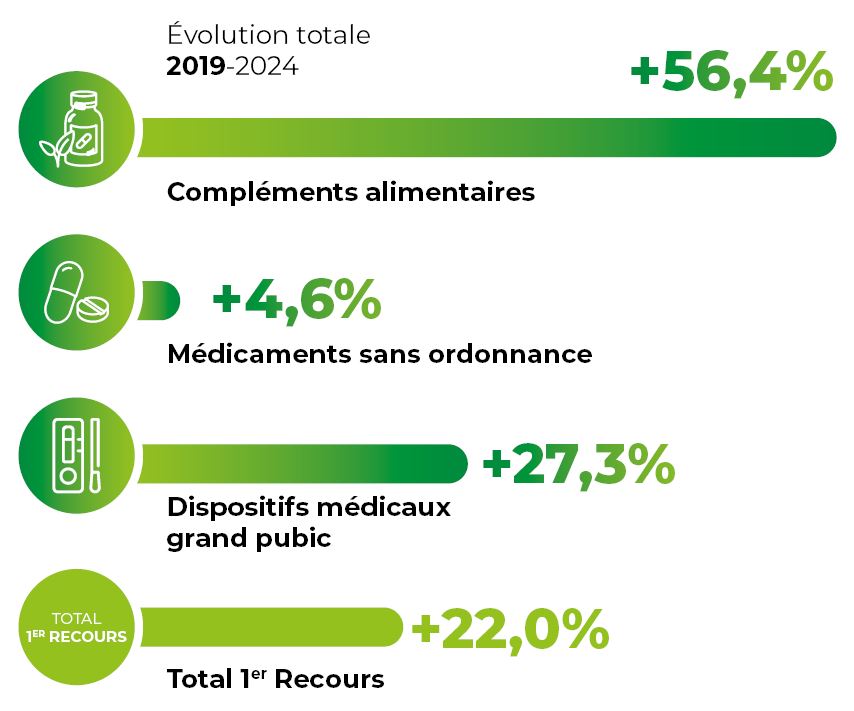
Evolution des produits de premier recours entre 2019 et 2024
À noter que les dispositifs médicaux représentent désormais la majorité des lancements sur les cinq dernières années, confirmant le dynamisme de cette catégorie de produits dans l’offre selfcare.

Lancements nouveaux produits de premier recours entre 2015 et 2024
Les principales préoccupations de santé se concentrent autour du sommeil et du stress (+8,7 %), de la vitalité (+4,9 %) et du système digestif (+4,5 %) — autant de besoins qui reflètent les priorités du quotidien.1
Complément alimentaire et dispositif médical : deux univers réglementaires, une complémentarité d’usage en selfcare
Ces têtes de classe du selfcare n’en demeurent pas moins des athlètes de disciplines différentes, soumis à des règles et des juges bien spécifiques.
Le complément alimentaire est, en droit européen, une denrée alimentaire présentée en doses ayant un effet nutritionnel ou physiologique et destinée à compléter l’alimentation.2 Ses promesses sont strictement encadrées : il peut revendiquer des allégations nutritionnelles ou de santé, du type « contribue à… », mais n’a pas le droit d’endosser des allégations médicales comme prévenir ou traiter une maladie.3
En France, sa première mise sur le marché passe par une télédéclaration (Compl’Alim), sans évaluation systématique par un tiers avant commercialisation. Le fabricant demeure pleinement responsable de la conformité.4
Le dispositif médical appartient, quant à lui, au champ des produits de santé. Il vise une finalité médicale — telle que prévenir, diagnostiquer, traiter ou atténuer une maladie ou une blessure — mais son action principale n’est pas pharmacologique : elle est mécanique ou physique (former un film protecteur, lubrifier, adsorber, créer une barrière anti-reflux, etc.)5. Ses allégations sont des allégations médicales et doivent être parfaitement cohérentes avec l’usage prévu. Côté preuves, la règle est claire : une évaluation clinique est requise, proportionnée à la classe de risque du dispositif (voir encadré).6 7
La mise sur le marché se fait via l’obtention du marquage CE après évaluation de conformité par un organisme notifié ou Notified body (pour la grande majorité des dispositifs médicaux sauf la plupart des classe I, où une auto-certification est suffisante). Ce marquage valable partout en Europe est un gage de sécurité et de performance clinique du produit permettant l’utilisation de claims médicaux en strict lien avec l’usage prévu.
Ces cadres réglementaires positionnent les deux catégories de façon différente mais complémentaire : le dispositif médical apporte une réassurance clinique accrue et des promesses thérapeutiques plus directement orientées vers le symptôme tandis que le complément alimentaire s’inscrit dans la physiologie et la prévention.
Cette complémentarité se manifeste aussi dans la possibilité de regrouper dispositifs médicaux et compléments alimentaires sous une même marque ombrelle, offrant ainsi au consommateur un repère commun. À condition toutefois de distinguer clairement les allégations et les présentations, afin d’éviter toute confusion réglementaire ou tromperie.
Réassurance scientifique et preuves d’efficacité : les atouts du dispositif médical
Dans l’univers des produits de santé sans prescription, les consommateurs s’attachent prioritairement à l’efficacité promise par la marque et expriment le besoin d’être conseillés, orientés dans leur choix. En effet, d’après Synadiet, 81% des consommateurs déclarent que la promesse du produit est leur premier critère de choix.8 Une enquête menée par Ipsos à l’échelle européenne en 2022 révèle même que 81 % des Européens considèrent essentiel d’obtenir une recommandation d’une source de confiance — médecin, pharmacien, entourage ou encore internet — et que près de la moitié des non-consommateurs envisageraient de franchir le pas si un professionnel de santé leur conseillait un produit.9
Dans ce contexte, la clarté des allégations et la réassurance qu’elles procurent jouent un rôle décisif.
Exemple avec le dispositif médical Humer Pharyngite10, marque du groupe Urgo : le support clinique du produit est valorisé grâce à des promesses fortes telles que la réduction de la douleur et de l’inflammation. On note également une volonté appuyée de proposer une solution qui concilie robustesse scientifique du dispositif médical avec naturalité : « Une formule qui puise sa force dans la synergie des sciences de la nature ».


Le dispositif médical peut revendiquer de véritables allégations médicales, étayées par un dossier clinique exigé lors de sa mise sur le marché. Cette caution scientifique et réglementaire rassure un consommateur de plus en plus en quête de preuves d’efficacité et de sécurité.
Prévention et usage traditionnel en selfcare : les atouts du complément alimentaire
Le complément alimentaire répond quant à lui à des attentes fortes liées à la prévention ou/et au maintien en bonne santé : immunité saisonnière, confort digestif, gestion du stress, beauté de la peau, entre autres. Sa richesse repose sur la diversité des ingrédients qu’il propose : vitamines, minéraux, acides gras mais aussi plantes dont l’usage traditionnel bénéficie d’un recul d’utilisation important. Là où le dispositif médical agit directement sur le symptôme, le complément alimentaire intervient généralement en amont, en aidant à limiter l’apparition des troubles. Il peut remplir sa fonction première qui consiste à créer un environnement favorable pour un bien-être sur le long terme mais aussi prendre le relai pour faciliter la récupération après un épisode symptomatique.
Compléments et dispositifs : différences utiles et synergies fortes au service du selfcare
L’exemple de GaviDigest illustre bien le positionnement spécifique des dispositifs médicaux dans la catégorie Digestion.11 Développé par Reckitt Benckiser, ce produit selfcare contre les flatulences et ballonnements revendique une efficacité rapide en deux heures, grâce à la technologie TransiProtect®. Celle-ci forme une couche protectrice sur les parois intestinales, permettant une action mécanique : apaiser, renforcer et restaurer pour limiter la réapparition des symptômes. La formule, à base de graines de tamarin et de protéines de pois, bénéficie d’une validation clinique mise en avant.

Sur la même indication, le complément alimentaire 5-Day Reset de la marque digitale Dijo revendique des allégations de type « aide à réduire les ballonnements ».12 Son efficacité revendiquée repose cette fois, non pas sur une action mécanique mais sur l’utilisation d’ingrédients traditionnellement reconnus pour favoriser le bon transit intestinal, notamment le carvi et le fenouil, associés au charbon végétal.

Dans l’indication minceur, un dispositif à base de fibres adsorbantes cible la réduction de l’apport lipidique et glucidique par un effet physique, pendant qu’un complément adresse l’équilibre nutritionnel et métabolique. Exemple avec les deux solutions complémentaires de Pomeol13 : le Capteur Acti Ball® en statut dispositif médical (complexe de fibres végétales) et le complément alimentaire Super métabolisme (vitamines B2, B6, pissenlit et chrome).


Même indication, promesses différentes, bénéfices complémentaires.
Construisons ensemble la gamme selfcare qui fera la différence
Dans un marché selfcare en pleine effervescence, la réussite d’une marque repose sur la cohérence et la pertinence de sa stratégie de gamme. Compléments alimentaires et dispositifs médicaux ne s’opposent pas : ils se complètent et offrent, chacun à leur manière, des réponses aux attentes des consommateurs.
L’enjeu consiste à définir la combinaison la plus pertinente au regard des cibles et du positionnement de la gamme. C’est précisément dans cette réflexion stratégique que BOTANIBRANDS intervient grâce à une double expertise en compléments alimentaires et en dispositifs médicaux.
Nous accompagnons les marques à chaque étape pour :
- Définir la meilleure stratégie de gamme selon le positionnement et les attentes du marché cible.
- Mettre à leur disposition des dispositifs médicaux en in-licensing, des solutions clé en main pour un accès rapide au marché
- Réaliser la due diligence technique et réglementaire de dispositifs médicaux, afin de sécuriser leur intégration dans un portefeuille de marques et leur mise sur le marché.
Vous souhaitez transformer vos idées en solutions selfcare performantes ?
Contactez-nous dès aujourd’hui !
| Zoom sur les classes de dispositifs médicaux oraux (UE) Principe général : la classification (I à III) dépend du niveau de risque. Plus le risque est élevé, plus les exigences cliniques et réglementaires avant marquage CE sont importantes. Classe I : faible risque, tels que les dispositifs non invasifs à action mécanique locale. Exemples : accessoires bucco-dentaires (gouttières, protections), pansements classiques. Classe IIa : risque potentiel mesuré tels que les dispositifs invasifs à usage temporaire (<60 min) ou à court terme (< 30 j). Exemples : sprays ou pastilles filmogènes pour gorge irritée, gels buccaux pour aphtes ou sécheresse, sirops pour la toux, films protecteurs des parois intestinales (ex : GaviDigest) destiné au traitement des troubles intestinaux. Classe IIb : risque potentiel significatif tels que les dispositifs invasifs à long terme (> 30 j) ou interagissant localement avec la fonction digestive. Exemples : capteurs de graisses ou de fibres pour le traitement de l’obésité, préparations à base de kaolin ou diosmectite pour le traitement de la diarrhée. Classe III : risque élevé tels que les dispositifs implantables, invasifs à long terme selon la partie du corps concernée (cœur, système nerveux central…) ou s’il a un effet biologique, et les dispositifs incorporant une substance assimilée à un médicament, plus rares car souvent requalifiés en médicaments. Sont soumis aux contrôles les plus stricts. Exemples : implants cardiaques, ciment osseux avec antibiotiques, dispositifs intra-utérins (DIU) contenant des substances médicamenteuses dont le cuivre ou l’argent. |
Sources :
- Baromètre NèreS 2024, Les pharmacies au cœur des évolutions de la santé de proximité.
- Directive 2002/46/EC of the European Parliament and of the Council of 10 June 2002 on the approximation of the laws of the Member States relating to food supplements
- Regulation (EC) No 1924/2006 of the European Parliament and of the Council of 20 December 2006 on nutrition and health claims made on foods
- TeleIcare : déclaration en ligne de mise sur le marché d’un complément alimentaire https://entreprendre.service-public.fr/vosdroits/R44574
- Regulation (EU) 2017/745 of the European Parliament and of the Council of 5 April 2017 on medical devices, amending Directive 2001/83/EC, Regulation (EC) No 178/2002 and Regulation (EC) No 1223/2009 and repealing Council Directives 90/385/EEC and 93/42/EEC (Text with EEA relevance. )
- MDR – Article 61 – Clinical evaluation
- MDR – Article 7 – Claims
- Baromètre 2024 de la consommation des compléments alimentaires en France, Toluna, Harris et Synadiet
- Consumer survey on food supplement in Europe – 2022 Ipsos
- https://humer-lagamme.fr/solutions/traitement-et-soin/gorge/humer-pharyngite/
- https://www.gavidigest.fr/nos-produits/flatulences-ballonnements/
- https://www.dijo.fr/products/5-day-reset
- https://pomeol.fr